
Matura z chemii na poziomie rozszerzonym to wyzwanie wymagające nie tylko teoretycznej wiedzy, ale także umiejętności analizy, wnioskowania i przeprowadzania obliczeń chemicznych. W niniejszym artykule przeanalizujemy zadania, których rozwiązanie sprawiło najwięcej problemu podczas próbnej matury z chemii 2025.
Próbna matura z chemii 2025 — analiza najtrudniejszych zadań
Matura próbna z chemii 2025 – zadanie 6
Już na samym początku trafiliśmy na zadanie, z którego rozwiązaniem poradziło sobie mniej niż 20% uczniów. Według mnie największy problem zadania numer 6 stanowią jednostki i umiejętność ich przeliczania. Pamiętajcie, że zarówno wartości niektórych jednostek oraz przedrostki jednostek miar znajdziecie w maturalnych kartach wzorów, z których możecie korzystać podczas egzaminu maturalnego. Dlatego gorąco Was zachęcam do dokładnego przejrzenia kart wzorów aby na maturze zaoszczędzić czas na wertowanie stron w poszukiwaniu parametrów potrzebnych do obliczenia zadania.
Przejdźmy do omówienia zadania - na samym początku musimy zauważyć, że w celu obliczenia energii potrzebnej do otrzymania jednego mola Ca2+ musimy zsumować wartość pierwszej i drugiej energii jonizacji, które mamy podane w tabeli:
E= Ej1 + Ej2 = 6,11 + 11,87= 17,98 eV
Otrzymany wynik w jednostce eV dotyczy energii potrzebnej do oderwania dwóch elektronów od jednego atomu Ca. Aby obliczyć wartość energii potrzebną dla jednego mola atomu Ca musimy skorzystać z liczby Avogadra.
Skoro 1 mol atomu to 6,02 • 1023 atomów to:
Emol= 6,02 • 1023 • 17,98 eV = 1,08 • 1025 eV
Otrzymana wartość to ilość energii potrzebna do oderwania dwóch elektronów od jednego mola atomów Ca.
Ponieważ molowa energia jonizacji podawana jest w jednostce kJ to następnym krokiem w tym zadaniu będzie wyrażenie otrzymanego wyniku właśnie w tej jednostce.
W tablicach maturalnych bez problemu znajdziecie, że:
1 eV = 1,602 • 10-19 J = 1,602 • 10-22 kJ
Tak więc nie pozostaje nam nic innego jak pomnożyć otrzymaną energię molową przez wartość eV:
Emol= 1,08•1025 •1,602•10-22 = 1730 kJ
W ten sposób otrzymaliśmy wartość energii jonizacji dla jednego mola atomów Ca.
Zadanie 12 na maturze próbnej z chemii
Zadanie numer 12. to typowe zadanie na tzw. tabelkę. Zacznijmy więc od jej narysowania:
|
Cpoczątkowe |
Zmiana | Crównowagowe | |
| CH4 | |||
| H2O | |||
| CO | |||
| H2 |
Przejdźmy do jej wypełnienia - będziemy wstawiali do tabelki wartości stężeń molowych, ponieważ potem te stężenia będziemy musieli podstawić do wyrażenia na stężeniową stałą równowagi.
Zobaczcie, że w tym przypadku nie mamy produktów na początku reakcji, więc zarówno dla wodoru jak i tlenku węgla w miejscu na początkowe stężenie molowe możemy wpisać 0. Natomiast o substratach wiemy tylko tyle, że zmieszane są równomolowo więc możemy założyć, że ich stężenia molowe na początku były równe x mol/dm3.
| Cpoczątkowe | Zmiana | Crównowagowe | |
| CH4 | x | ||
| H2O | x | ||
| CO | 0 | ||
| H2 | 0 |
Dodatkowo mamy podaną liczbę moli wodoru w stanie równowagi oraz objętość reaktora równą 20 dm3 – na podstawie tych danych obliczymy stężenie równowagowe wodoru, korzystając ze wzoru na stężenie molowe:
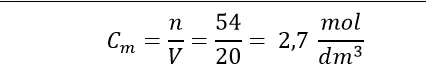
Tę wartość wpiszemy do tabelki w miejscu na stężenie równowagowe wodoru. W takim razie w wyniku reakcji powstało 2,7 mol/dm3 wodoru. Środkową kolumnę zawsze dotyczy stechiometrycznych zmian stężeń reagentów. Tak więc, wiedząc ile powstało w wyniku reakcji wodoru obliczymy na podstawie stechiometrii reakcji ile równocześnie musiało powstać tlenku węgla(II) a ile ubyło metanu i pary wodnej. Widzimy, że tlenku węgla(II) musiało przybyć 3 razy mniej niż wodoru. Natomiast metanu i wody przereagowało dokładnie tyle samo ile powstało tlenku węgla(II).
| Cpoczątkowe | Zmiana | Crównowagowe | |
| CH4 | x |
-0,9 |
|
| H2O | x |
-0,9 |
|
| CO | 0 |
+0,9 |
|
| H2 | 0 |
+2,7 |
2,7 |
Teraz możemy obliczyć stężenia wszystkich reagentów w stanie równowagi:
| Cpoczątkowe | Zmiana | Crównowagowe | |
| CH4 | x |
-0,9 |
x-0,9 |
| H2O | x |
-0,9 |
x-0,9 |
| CO | 0 |
+0,9 |
0,9 |
| H2 | 0 |
+2,7 |
2,7 |
Wartość stężeniowej stałej równowagi mamy podaną w informacji wstępnej. Pamiętajcie, że musimy spisać wartość w temperaturze 1398 K, czyli Kc=4,6.
Podstawiamy do wyrażenia na stałą K i wyliczamy wartość x:
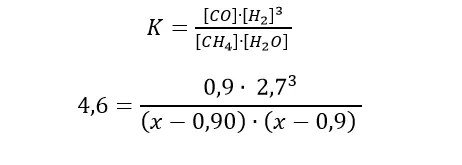
Warunki zadania spełnia tylko wartość x = 2,86 mol/dm3, czyli stężenie początkowe zarówno metanu jak i pary wodnej było równe
2,86 mol/dm3.
Możemy przejść do ostatniego już kroku w tym zadaniu czyli do policzenia jaki procent początkowej ilości metanu przereagował:
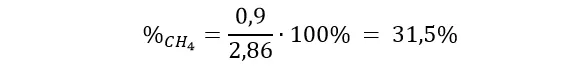
Zadanie 20 na maturze próbnej z chemii
W zadaniu numer 20. mieliśmy wykazać na podstawie obliczeń, że kwasem użytym do miareczkowania był kwas octowy. Jednym ze sposobów, którym będziemy mogli to wykazać będzie obliczenie wartości stałej dysocjacji K użytego kwasu na podstawie jego początkowej wartości pH.
W celu wyznaczenia wartości stałej K, skorzystamy z następującego wzoru:
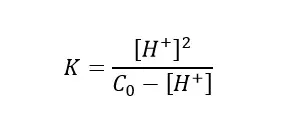
Z wykresu odczytujemy początkową wartość pH, która wynosi 3,03. Na tej podstawie wyliczymy stężenie jonów H+ korzystając z następującej zależności:
[H+] = 10-pH = 10-3,03 = 9,3•10-4 mol/dm3
Mając stężenie kationów wodoru oraz początkowe stężenie kwasu (jest podane w treści zadania) jesteśmy w stanie wyliczyć wartość stałej K, podstawiając wszystkie dane do wzoru:
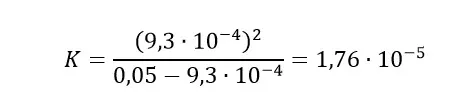
Otrzymujemy wartość stałej K = 1,76•10-5
Teraz nie pozostaje nam nic innego jak otworzyć Karty maturalne na stronie z Wartościami stałych dysocjacji i sprawdzić czy taka wartość odpowiada kwasowi octowemu.

Bingo! Udowodniliśmy, że miareczkowanym kwasem był kwas octowy.
Matura rozszerzona chemia – sprawdź zadanie 23
Zadanie numer 23. dotyczyło wyznaczenia wzoru hydratu kwasu szczawiowego. Przypomnijmy sobie zatem, co to są hydraty. Hydraty to nic innego jak sole uwodnione, które w swojej strukturze mają wbudowane cząsteczki wody.
W celu wyznaczenia wzoru hydratu zostało przeprowadzone miareczkowanie redoksymetryczne. Redoksymetria to technika analizy chemicznej oparta na reakcjach utleniania i redukcji. Jest wykorzystywana do oznaczania stężenia substancji redukujących i utleniających w roztworach. Proces ten polega na miareczkowaniu substancji badanego roztworu za pomocą roztworu mianowanego o znanym stężeniu, w którym zachodzi reakcja redoks.
Aby poprawnie wyznaczyć wzór hydratu musimy obliczyć, ile w próbce hydratu znajdowało się soli bezwodnej a ile wody hydratacyjnej.
W treści zadania mamy podane stężenie i objętość manganianu(VII) potasu, który był użyty do miareczkowania - na tej podstawie wyliczymy liczbę moli manganianu(VII):
n = 0.3 mol/dm3 • 0,0185 dm3 = 0,0056mola manganianu(VII) potasu
Na podstawie liczby moli zużytego manganianu(VII) i stechiometrii reakcji jesteśmy w stanie wyliczyć liczbę moli kwasu szczawiowego, który poddano miareczkowaniu. Ze stechiometrii reakcji widzimy, że 2 mole MnO4- reagują z 9 molami C2O42-, zatem:
0,0056 mola MnO4- - y moli C2O42-
Teraz nie pozostaje nam nic innego jak obliczyć jaką masę stanowi wyliczona przez nas liczba moli kwasu szczawiowego. W tym celu policzmy jego masę molową:
Przechodzimy teraz do najbardziej kluczowego momentu zadania. Aby wyznaczyć wzór hydratu kwasu szczawiowego musimy obliczyć ile moli wody będzie przypadało na jeden mol kwasu.
W treści zadania mieliśmy podaną masę próbki hydratu - odejmując od tego wyliczoną przez nas masę kwasu obliczymy masę wody hydratacyjnej.
Masa wody= 3,15 g - 2,25 g = 0,9 g H2O
Przeliczmy zatem ile gram wody przypadnie na jeden mol kwasu, wykorzystując do tego jego masę molową:
Tak więc, w 1 molu hydratu znajduje się 36 gram wody.
Zaminiamy podaną masę wody na mole:
i otrzymujemy wzór hydratu: H2C2O4 • 2 H2O.
Zadanie 30 na maturze próbnej z chemii
W zadaniu numer 30. musieliśmy rozwiązać ciąg przemian chemicznych i podać wzory półstrukturalne głównych produktów poszczególnych etapów. Zwróćcie jeszcze raz na to uwagę- głównych produktów reakcji chemicznych.
W reakcji oznaczonej na schemacie numerem 1. zachodzi reakcja addycji elektrofilowej cząsteczki HBr do alkenu. W tym przypadku musimy zwrócić uwagę, że mamy do czynienia z niesymetryczną cząsteczką i addycja ta będzie przebiegała zgodnie z regułą Markownikowa.
Reguła Markownikowa mówi, że atom wodoru dołączą się do tego węgla przy wiązaniu podwójnym, który posiada mniejszą rzędowość, czyli do takiego, który związany jest z większą liczbą atomów wodoru. Tak więc główny produkt pierwszej przemiany będzie wyglądał następująco:
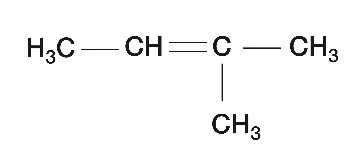
Kolejny etap, przebiega w podwyższonej temperaturze i w środowisku etanolowego roztworu NaOH. Takie warunki będą powodowały sumarycznie eliminację cząsteczki HBr od otrzymanej w poprzednim etapie bromopochodnej. Eliminacja będzie przebiegała zgodnie z regułą Zajcewa - atom wodoru w produkcie głównym reakcji zostanie oderwany od tego atomu węgla, który związany jest z mniejszą ilością wodorów.
W tym miejscu warto przypomnieć sobie bardzo podobną reakcję dotyczącą halogenopochodnych alkanów - mianowicie reakcję z mocną zasadą ale tym razem w środowisku wodnym. Gdy mamy do czynienia z takimi warunkami to przebiega wtedy reakcja substytucji nukleofilowej i otrzymujemy cząsteczkę alkoholu. Ale wróćmy do naszego zadania - główny produkt eliminacji przebiegającej zgodnie
z regułą Zajcewa będzie miał następujący wzór:
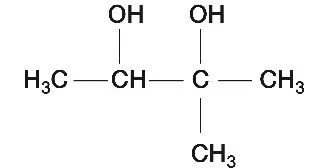
W ostatnim już etapie, na otrzymany alken działamy wodnym roztworem manganianu(VII) potasu. Reakcja ta, jest jedną z metod identyfikacji wiązania podwójnego w cząsteczce i równocześnie metodą otrzymywania alkoholi polihydroksylowych. W tych warunkach dochodzi do rozerwania wiązania podwójnego i przyłączenia do obu atomów węgla grup hydroksylowych:
Próbna matura z chemii - zadanie 37.2
W zadaniu 37.2. musieliśmy wykazać odczyn roztworu N-metylometanoaminy. Tak naprawdę określenie tego odczynu było konieczne już
w zadaniu 37.1. aby poprawnie dopasować numery fotografii do poszczególnych etapów doświadczenia.
N-metylometanoamina należy do amin. Aminy ze względu na obecność wolnej pary elektronowej na atomie azotu będą wykazywały odczyn zasadowy. Reakcją potwierdzającą odczyn zasadowy amin jest reakcja z wodą przebiegająca w następujący sposób:
(CH3)2NH + H2O (CH3)2NH2+ + OH-
Tak jak widzimy w reakcji powstają jony OH-, które będą decydowały o zasadowym odczynie roztworu.
Zadanie nr 40 – matura chemia 2025
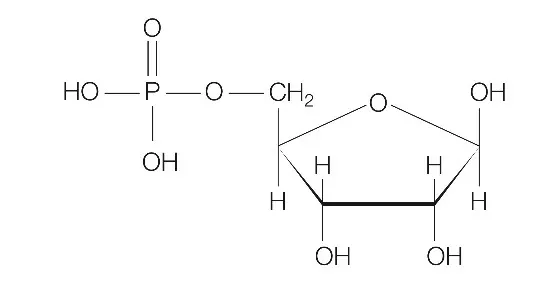
Zadanie 40. dotyczyło przeprowadzenia reakcji estryfikacji pomiędzy 5. atomem węgla cząsteczki D-rybozy a kwasem ortofosforowym(V). Zwróćcie uwagę, że w informacji wstępnej macie podany wzór D-rybozy w projekcji Hawortha i dodatkowo zostały ponumerowane już atomy węgla.
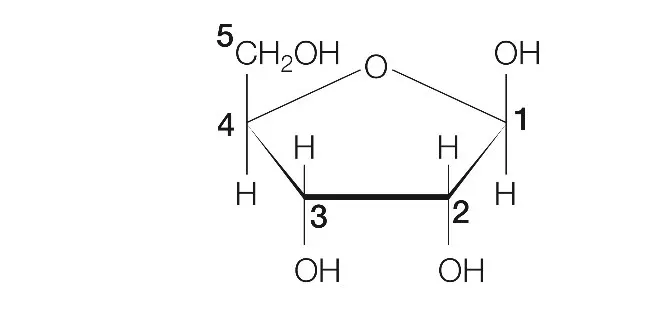
To co mogło być zaskakujące w tym zadaniu to to, że reakcja estryfikacji może również zachodzić dla kwasów nieorganicznych. W strukturze cząsteczek kwasów nieorganicznych możemy wyróżnić grupy hydroksylowe, które będą ulegały reakcji estryfikacji z cząsteczkami alkoholi. Co prawda, w otrzymanych estrach nie będziemy mieli klasycznego wiązania estrowego tak jak w przypadku estryfikacji kwasu karboksylowego alkoholem to mimo tego związki takie zaliczamy do estrów.
Tak więc reakcja estryfikacji zajdzie pomiędzy jedną grupą hydroksylową pochodzącą od cząsteczki kwasu ortofosforowego(V) a grupą hydroksylową znajdującą się przy 5. atomie węgla cząsteczki D-rybozy. W wyniku tej reakcji otrzymamy następujący produkt:
Podsumowanie – matura próbna z chemii 2025
Podsumowując analizę arkusza maturalnego z chemii na poziomie rozszerzonym, można zauważyć, że tegoroczne zadania wymagają nie tylko dobrej znajomości teorii, ale także umiejętności logicznego myślenia, analizowania danych i sprawnego wykonywania obliczeń.
Maturzyści, przed Wami ostatnie tygodnie przygotowań – warto wykorzystać je na systematyczne powtarzanie materiału i rozwiązywanie jak największej liczby zadań. Życzymy Wam powodzenia na egzaminie w maju! Niech zdobyta wiedza i umiejętności pozwolą Wam osiągnąć jak najlepszy wynik i otworzyć drzwi do wymarzonych studiów. Powodzenia!










